概要
当社の NC-6004(シスプラチンミセル)開発プログラムの⼀つである膵がんを対象とした第Ⅲ相試験について、本試験に基づく承認申請はしないこととする結論に⾄りましたのでお知らせいたします。尚、国内データによると、NC-6004 併⽤による⽣存期間の延⻑が⽰唆されており、将来的な国内開発の可能性について引き続き検討してまいります。
当社は、2014 年より膵がんを対象とした NC-6004 とゲムシタビンの併⽤第Ⅲ相試験を実施してまいりました。近年、膵がん治療の標準療法が変化し、ゲムシタビンが第⼀選択薬ではなくなったことから、膵がん治療薬としての有⽤性を⽰すためには追加の申請⽤試験が必要になると判断いたしました。本試験につきましては、今後、共同開発およびライセンス先である Orient Europharma Co., Ltd. (台湾、OEP 社)により、データベース固定および詳細解析が実施される予定です。
別途、頭頸部がんを対象とした免疫チェックポイント阻害剤併⽤による第Ⅱ相試験を実施中です。当社は、近年のがん治療のトレンドである免疫チェックポイント阻害剤との併⽤に注⼒するとともに、NC-6004 の強みを活かし、承認取得に向けた戦略を遂⾏してまいります。
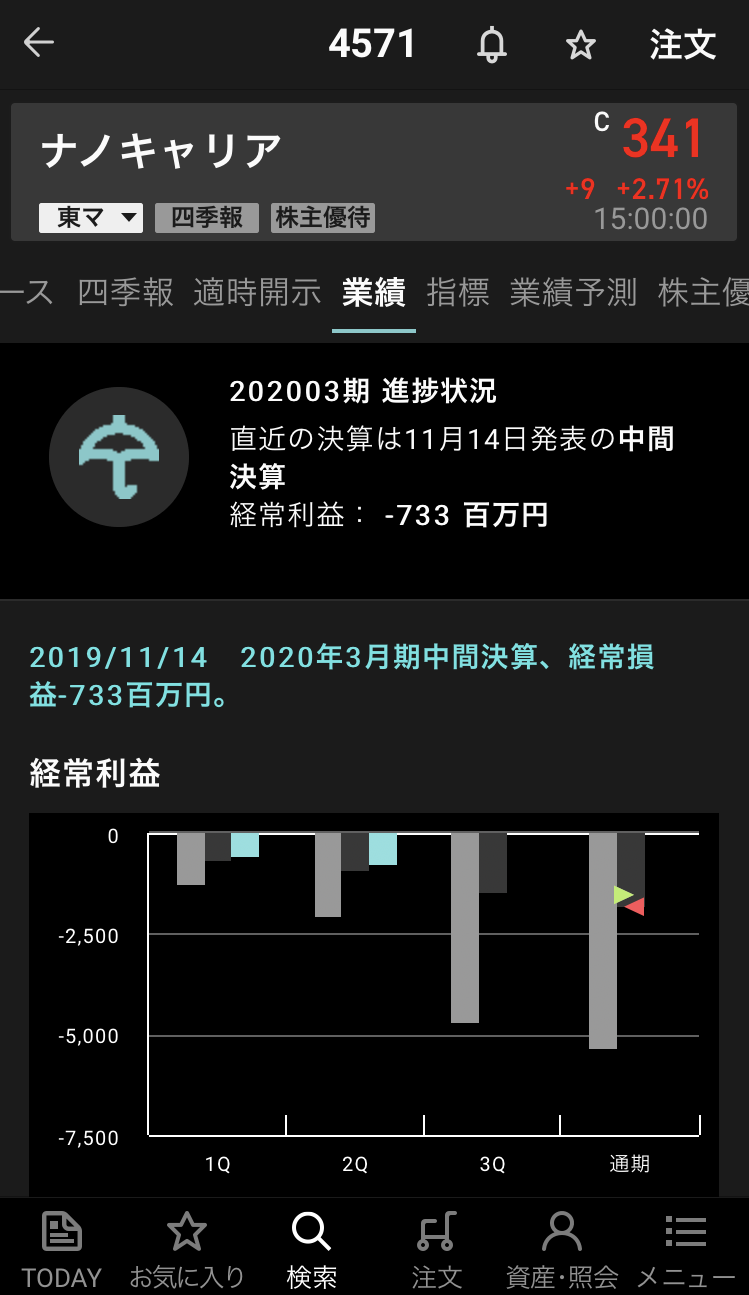
尚、本件による 2020 年 3 ⽉期業績への影響はございません。引き続き、ミセル化ナノ粒⼦医薬品の実現に向けた活動を推進してまいります。
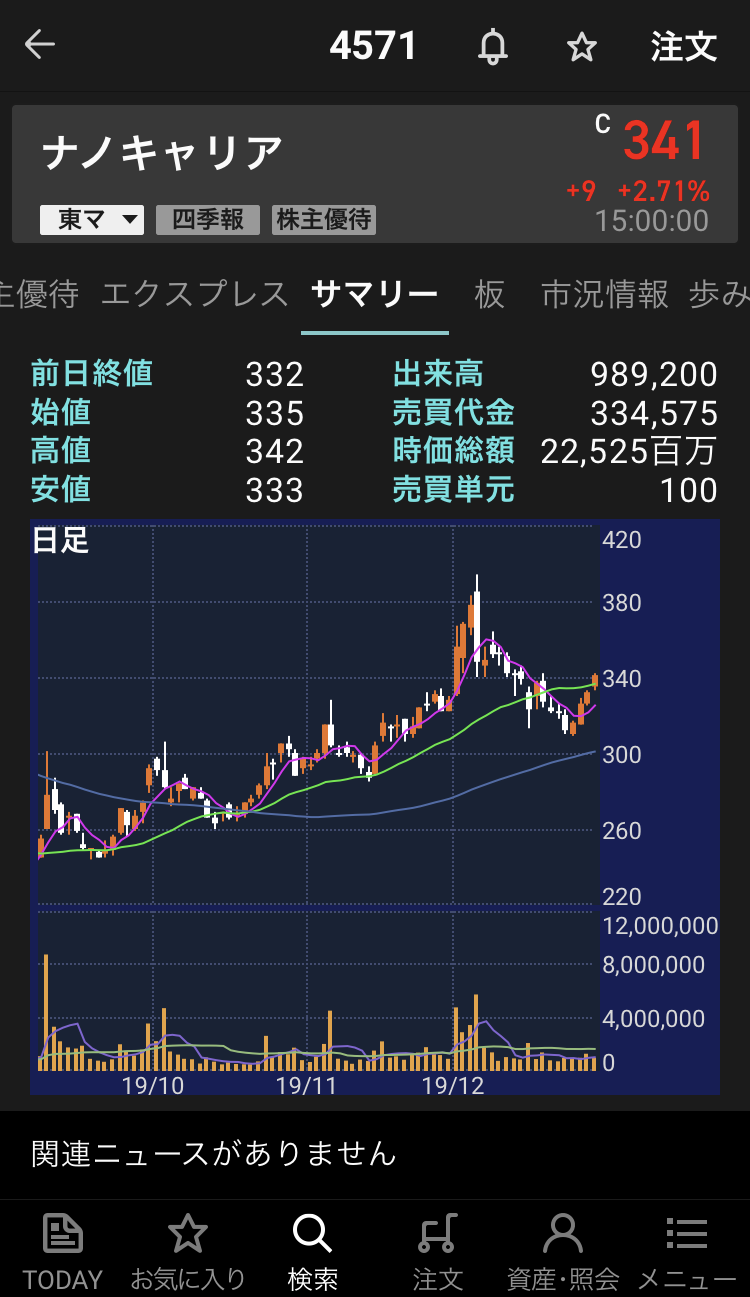
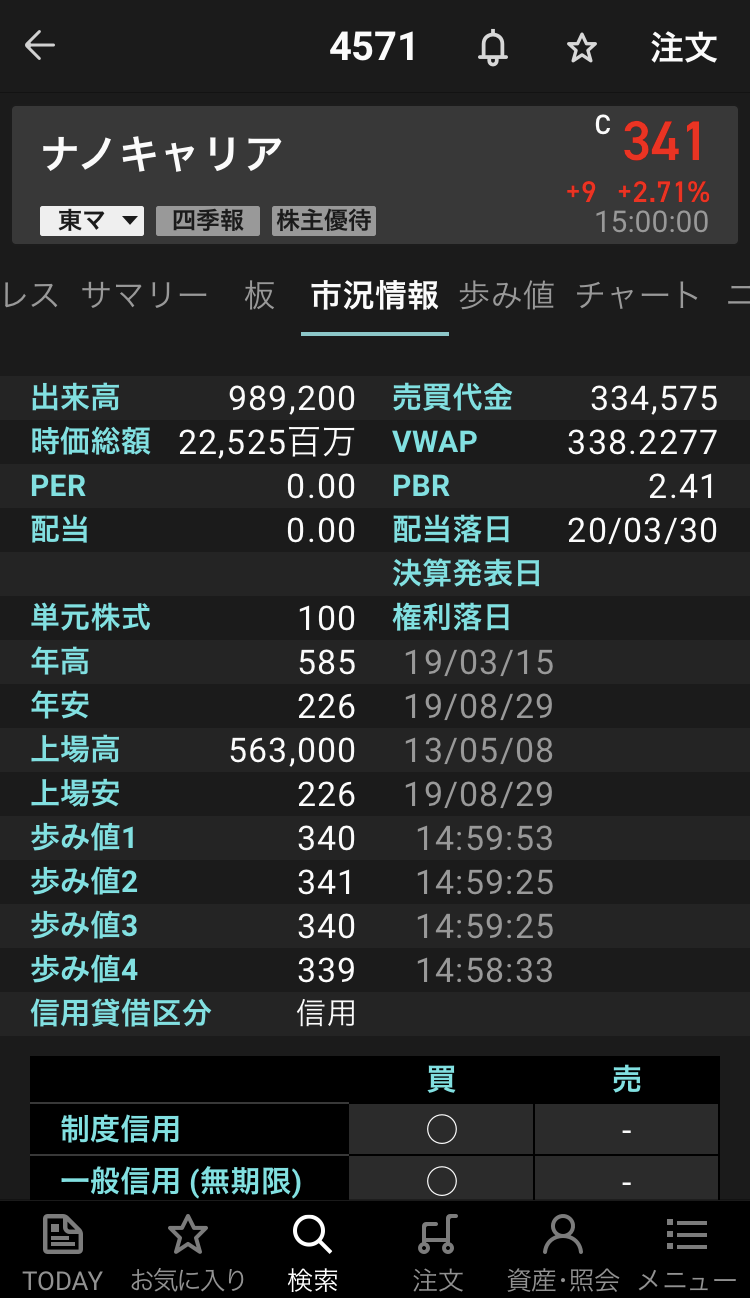
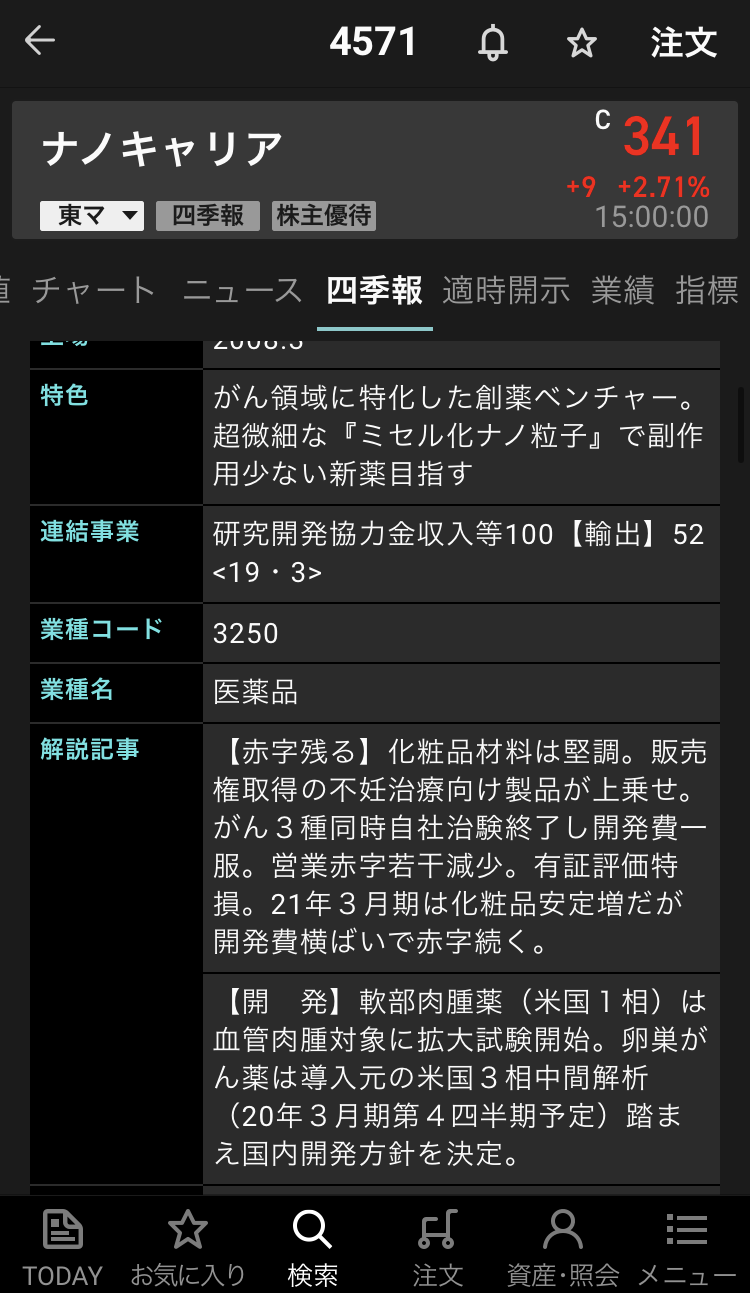
ナノキャリア【4571】の情報